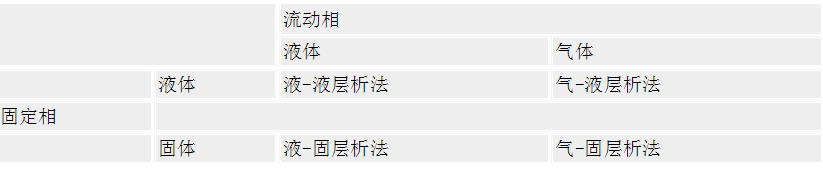
表16-6 按层析原理分类
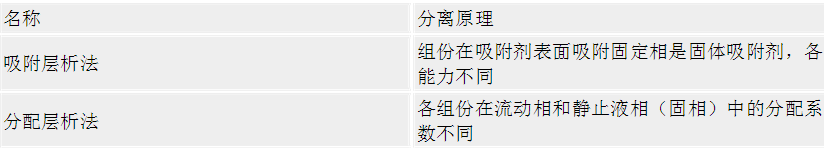
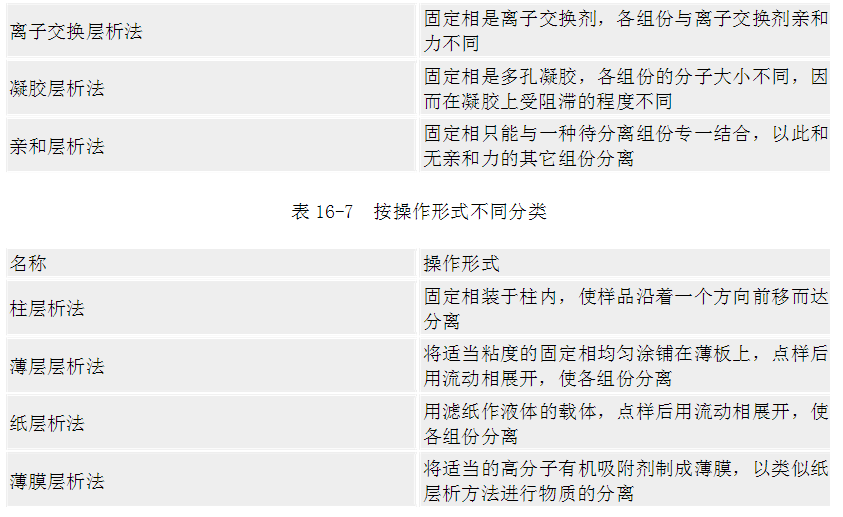
二、层析法实验技术 (一)凝胶层析法
凝胶层析又称分子筛过滤、排阻层析等。它的突出优点是层析所用的凝胶属于惰性载体,不带电荷,吸附力弱,操作条件比较温和,可在相当广的温度范围下进行,不需要有机溶剂,并且对分离成分理化性质的保持有独到之处。对于高分子物质有很好的分离效果。
⒈凝胶的选择根据实验目的不同选择不同型号的凝胶。如果实验目的是将样品中的大分子物质和小分子物质分开,由于它们在分配系数上有显著差异,这种分离又称组别分离,一般可选用
Sephadex G-25和G-50,对于小肽和低分子量的物质(1000-5000)的脱盐可使用Sephadex G-10,G-15及Bio-Gel-p-2或4。如果实验目的是将样品中一些分子量比较近似的物质进行分离,这种分离又叫分级分离。一般选用排阻限度略大于样品中**高分子量物质的凝胶,层析过程中这些物质都能不同程度地深入到凝胶内部,由于Kd不同,**后得到分离。
⒉柱的直径与长度根据经验,组别分离时,大多采用2-30cm长的层析柱,分级分离时,一般需要100cm左右长的层析柱,其直径在1-5cm范围内,小于1cm产生管壁效应,大于5cm则稀释现象严重。长度L与直径D的比值L/D一般宜在7-10之间,但对移动慢的物质宜在30-40之间。 ⒊凝胶柱的制备凝胶型号选定后,将干胶颗粒悬浮于5-10倍量的蒸馏水或洗脱液中充分溶胀,溶胀之后将极细的小颗粒倾泻出去。自然溶胀费时较长,加热可使溶胀加速,即在沸水浴中将湿凝胶浆逐渐升温**近沸,1-2小时即可达到凝胶的充分胀溶。加热法既可节省时间又可消毒。 凝胶的装填:将层析柱与地面垂直固定在架子上,下端流出口用夹子夹紧,柱顶可安装一个带有搅拌装置的较大容器,柱内充满洗脱液,将凝胶调成较稀薄的浆头液盛于柱顶的容器中,然后在微微地搅拌下使凝胶下沉于柱内,这样凝胶粒水平上升,直到所需高度为止,拆除柱顶装置,用相应的滤纸片轻轻盖在凝胶床表面。稍放置一段时间,再开始流动平衡,流速应低于层析时所需的流速。在平衡过程中逐渐增加到层析的流速,千万不能超过**终流速。平衡凝胶床过夜,使用前要检查层析床是否均匀,有无“纹路”或气泡,或加一些有色物质来观察色带的移动,如带狭窄、均匀平整说明层析柱的性能良好,色带出现歪曲、散乱、变宽时必须重新装柱。
⒋加样和洗脱凝胶床经过平衡后,在床顶部留下数亳升洗脱液使凝胶床饱和,再用滴管加入样品。一般样品体积不大于凝胶总床体积的5%-10%。样品浓度与分配系数无关,故样品浓度可以提高,但分子量较大的物质,溶液的粘度将随浓度增加而增大,使分子运动受限,故样品与洗脱液的相对粘度不得超过1.5-2。样品加入后打开流出口,使样品渗入凝胶床内,当样品液面恰与凝胶床表面相平时,再加入数毫升洗脱液中洗管壁,使其全部进入凝胶床后,将层析床与洗脱液贮瓶及收集器相连,预先设计好流速,然后分部收集洗脱液,并对每一馏份做定性、定量测定。 ⒌凝胶柱的重复使用、凝胶回收与保存一次装柱后可以反复使用,不必特殊处理,并不影响分离效果。为了防止凝胶染菌,可在一次层析后加入0.02%的叠氮钠,在下次层析前应将抑菌剂除去,以免干扰洗脱液的测定。 #p#分页标题#e#
如果不再使用可将其回收,一般方法是将凝胶用水冲洗干净滤干,依次用70%、90%、95%乙醇脱水平衡**乙醇浓度达90%以上,滤干,再用乙醚洗去乙醇、滤干、干燥保存。湿态保存方法是凝胶浆中加入抑菌剂或水冲洗到中性,密封后高压灭菌保存。 ⒍凝胶层析的应用
⑴脱盐:高分子(如蛋白质、核酸、多糖等)溶液中的低分子量杂质,可以用凝胶层析法除去,这一操作称为脱盐。本法脱盐操作简便、快速、蛋白质和酶类等在脱盐过程中不易变性。适用的凝胶为SephadexG-10、15、25或Bio-Gel-p-2、4、6。柱长与直径之比为5-15,样品体积可达柱床体积的25%-30%,为了防止蛋白质脱盐后溶解度降低会形成沉淀吸附于柱上,一般用醋酸铵等挥发性盐类缓冲液使层析柱平衡,然后加入样品,再用同样缓冲液洗脱,收集的洗脱液用冷冻干燥法除去挥发性盐类。
⑵用于分离提纯:凝胶层析法已广泛用于酶、蛋白质、氨基酸、多糖、激素、生物碱等物质的分离提纯。凝胶对热原有较强的吸附力,可用来去除无离子水中的致热原制备注射用水。 ⑶测定高分子物质的分子量:用一系列已知分子量的标准品放入同一凝胶柱内,在同一条件下层析,记录每一分钟成分的洗脱体积,并以洗脱体积对分子量的对数作图,在一定分子量范围内可得一直线,即分子量的标准曲线。测定未知物质的分子量时,可将此样品加在测定了标准曲线的凝胶柱内洗肿后,根据物质的洗脱体积,在标准曲线上查出它的分子量。
⑷高分子溶液的浓缩:通常将SephadexG-25或50干胶投入到稀的高分子溶液中,这时水分和低分子量的物质就会进入凝胶粒子内部的孔隙中,而高分子物质则排阻在凝胶颗粒之外,再经离心或过滤,将溶胀的凝胶分离出去,就得到了浓缩的高分子溶液。 (二)离子交换层析法
离子交换层析法是以具有离子交换性能的物质作固定相,利用它与流动相中的离子能进行可逆的交换性质来分离离子型化合物的一种方法。
⒈离子交换剂预处理和装柱对于离子交换纤维素要用流水洗去少量碎的不易沉淀的颗粒,以保证有较好的均匀度,对于已溶胀好的产品则不必经这一步骤。溶胀的交换剂使用前要用稀酸或稀碱处理,使之成为带H+或OH-的交换剂型。阴离子交换剂常用“碱-酸-碱”处理,使**终转为-OH-型或盐型交换剂;对于阳离子交换剂则用“酸-碱-酸”处理,使**终转为-H-型交换剂。洗涤好的纤维素使用前必须平衡**所需的pH和离子强度。已平衡的交换剂在装柱前还要减压除气泡。为了避免颗粒大小不等的交换剂在自然沉降时分层,要适当加压装柱,同时使柱床压紧,减少死体积,有利于分辨率的提高。柱子装好后再用起始缓冲液淋洗,直**达到充分平衡方可使用。
⒉加样与洗脱加样:层析所用的样品应与起始缓冲液有相同的pH和离子强度,所选定的pH值应落在交换剂与被结合物有相反电荷的范围,同时要注意离子强度应低,可用透析、凝胶过滤或稀释法达此目的。样品中的不溶物应在透析后或凝胶过滤前,以离心法除去。为了达到满意的分离效果,上样量要适当,不要超过柱的负荷能力。柱的负荷能力可用交换容量来推算,通常上样量为交换剂交换总量的1%-5%。
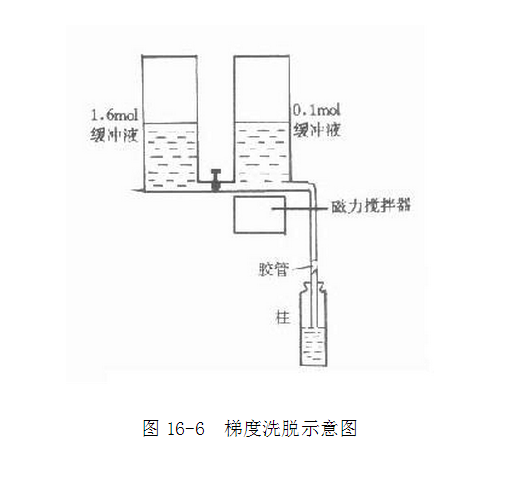
洗脱:已结合样品的离子交换前,可通过改变溶液的pH或改变离子强度的方法将结合物洗脱,也可同时改变pH与离子强度。为了使复杂的组份分离完全,往往需要逐步改变pH或离子强度,其中**简单的方法是阶段洗脱法,即分次将不同pH与离子强度的溶液加入,使不同成分逐步洗脱。由于这种洗脱pH与离子强度的变化大,使许多洗脱体积相近的成分同时洗脱,纯度较差,不适宜精细的分离。**好的洗脱方法是连续梯度洗脱,洗脱装置见图16-6。两个容器放于同一水平上,**个容器盛有一定pH的缓冲液,第二个容器含有高盐浓度或不同pH的缓冲液,两容器连通,**个容器与柱相连,当溶液由**容器流入柱时,第二容器中的溶液就会自动来补充,经搅拌与**容器的溶液相混合,这样流入柱中的缓冲液的洗脱能力即成梯度变化。**容器中任何时间的浓度都可用下式进行计算: C=C2-(C2-C1)(1-V)A2/A1
式中A1、A2分别代表两容器的截面积:C1、C2分别表示容器中溶液的浓度;V为流出体积对总体积之比。当A1=A2时为线性梯度,当A1>A2时为凹形梯度,A1>A2时为凸形梯度。
洗脱时应满足以下要求:①洗脱液体积应足够大,一般要几十倍于床体积,从而使分离的各峰不致于太拥挤。②梯度的上限要足够高,使紧密吸附的物质能被洗脱下来。③梯度不要上升太快,要恰好使移动的区带在快到柱末端时达到解吸状态。目的物的过早解吸,会引起区带扩散;而目的物的过晚解吸会使峰形过宽。
⒊洗脱馏份的分析 按一定体积(5-10ml/管)收集的洗脱液可逐管进行测定,得到层析图谱。依实验目的的不同,可采用适宜的检测方法(生物活性测定、免疫学测定等)确定图谱中目的物的位置,并回收目的物。
#p#分页标题#e#
⒋离子交换剂的再生与保存离子交换剂可在柱上再生。如离子交换纤维素可用2mol/:NaCl淋洗柱,若有强吸附物则可用0.1mol/l NaOH洗柱;若有脂溶性物质则可用非离子型去污剂洗柱后再生,也可用乙醇洗涤,其顺序为:0.5mol/l NaOH-水-乙醇-水-20%NaOH-水。保存离子交换剂时要加防腐剂。对阴离子交换剂宜用0.002%氯已定(洗必泰),阳离子交换剂可用乙基硫柳汞(0.005%)。有些产品建立用0.02%叠氮钠。
⒌离子交换层析的应用离子交换层析技术已广泛用于各学科*域。在生物化学及临床生化检验中主要用于分离氨基酸、多肽及蛋白质,也可用于分离核酸、核苷酸及其它带电荷的生物分子。 (三)高效液相层析法
高效液相层析法(HPLC)是近二十年来发展起来的一项新颖快速的分离技术。它是在经典液相层析法基础上,引进了气相层析的理论具有气相层析的全部优点。由于HPLC分离能力强、测定灵敏度高,可在室温下进行,应用范围极广,无论是极性还是非极性,小分子还是大分子,热稳定还是不稳定的化合物均可用此法测定。对蛋白质、核酸、氨基酸、生物碱、类固醇和类脂等尤为有利。 高效液相层析法的基本概念和分离理论与经典的液相色谱法及气相色谱法一致,因而其塔板理论及动力学理论等都可用于高效液相层析。
⒈高效液相
层析仪典型的高效液相
层析仪包括输液系统、层析柱与检测系统三部分。流动相用一高压泵输入。这种高压泵应满足以下条件:①流量恒定,无脉动,并有较大的调节范围。②能抗溶剂腐蚀。③有较高的输出压力,一般要达到15~300kg/c,也有的高达800kg/c。④泵的死体积要小。梯度洗脱装置必须具备两台高压泵,一台输送强溶剂,一台输送弱溶剂,两泵运转速度用电脑控制,并可按一定的要求改变流动相的组成,以改善分离效果。一般用微量注射器直接进样,也可采用六通阀门进样。HPLC中所用的检测器**多应用的是紫外吸收检测,灵敏度可达ng水平。此外,还有荧光检测器、示差析光检测器、电化学检测器等。 ⒉HPLC的类型与应用
⑴液-固吸附层析:固定相是具有吸附活性的吸附剂,常用的有硅胶、氧化铝、高分子有机酸或聚酰胺凝胶等。液-固吸附层析中的流动相依其所起的作用不同,分为“底剂”和洗脱剂两类,底剂起决定基本色谱的分离作用,洗脱剂起调节试样组份的滞留时间长短,并对试样中某几个组份具有选择性作用。流动相中底剂与洗脱剂成分的组合和选择,直接影响色谱的分离情况,一般底剂为极性较低的溶剂,如正已烷、环已烷、戊烷、石油醚等,洗脱剂则根据试样性质选用针对性溶剂,如醚、酯、酮、醇和酸等。本法可用于分离异构体、抗氧化剂与维生素等。
⑵液-液分配层析:固定相为单体固定液构成。将固定液的官能团结合在薄壳或多孔型硅胶上,经酸洗、中和、干燥活化、使表面保持一定的硅羟基。这种以化学键合相为固定相的液-液层析称为化学键合相层析。另一种利用离子对原理的液-液分配层析为离子对层析。化学键合层析分:①极性键合相层析:固定相为极性基团,氰基、氨基及双羟基三种。流动相为非极性或极性较小的溶剂。极性小的组份先出峰,极性大的后出峰,这称为正相层析法,适用于分离极性化合物。②非极性键合相层析:固定相为非极性基团,如十八烷基(C18)、辛烷基(C8)、甲基与苯基等,流动相用强极性溶剂,如水、醇、乙腈或无机盐缓冲液。**常用的是不同比例的水和甲醇配制的混合溶剂,水不仅起洗脱作用还可掩盖载体表面的硅羟基,防止因吸附而**的拖尾现象。极性大的组份先出峰,极性小的组份后出峰,恰好与正相法相反,故称反相层析。本法适用于小分子物质的分离,如肽、核苷酸、糖类、氨基酸的衍生物等。离子对分配层析分:①正相离子对层析:此法常以水吸附在硅胶上作为固定相,把与分离组份带相反电荷的配对离子以一定浓度溶于水或缓冲液涂渍在硅胶上。流动相为极性较低的有机溶剂。在层析过程中,待分离的离子与水相中配对离子形成中性离子对,在水相和有机相中进行分配,而达到分离。本法优点是流动相选择余地大,缺点是固定相易流失。②反向离子对层析:固定相是疏水性键合硅胶,如C18键合相,待分离离子和带相反电荷的配对离子同时存在于强极性的流动相中,生成的中性离子对在流动相和键合相之间进行分配,而得到分离。本法优点是固定相不存在流失问题、流动相含水或缓冲液更适用于电离性化合物的分离。 ⑶离子交换层析:原理与普通离子交换相同。在离子交换HPLC中,固定相多用离子性键合相,故本法又称离子性键合相层析。流动相主要是水溶液,pH值**好在被分离酸、碱的pK值附近。 (四)亲和层析法
亲和层析是利用待分离物质和它的特异性配体间具有特异的亲和力,从而达到分离目的的一类特殊层析技术。
具有专一亲和力的生物分子对主要有:抗原与抗体、DNA与互补DNA或RNA、酶与它的底物或竞争性抑制剂、激素(或药物)与它们的受体、维生素和它的特异结合蛋白、糖蛋白与它相应的植物凝集素等。可亲和的一对分子中的一方以共价键形式与不溶性载体相连作为固定相吸附剂,当含有混合组份的样品通过此固定相时,只有和固定相分子有特异亲和力的物质,才能被固定相吸附结合,其它没有亲和力的无关组份就随流动相流出,然后改变流动组成份,将结合的亲和物洗脱下来。亲和层析中所用的载体称为基质,与基质共价连接的化合物称配基。 #p#分页标题#e#
亲和层析纯化过程简单、迅速,且分离效率高。对分离含量极少又不稳定的活性物质尤为有效。但本法必须针对某一分离对象,制备专一的配基和寻求层析的稳定条件,因此亲和层析的应用范围受到了一定的限制。
亲和层析可用于纯化生物大分子:稀溶液的浓缩;不稳定蛋白质的贮藏;从纯化的分子中除去残余的污染物;用免疫吸附剂吸附纯化对此尚无互补配体的生物大分子;分离核酸是亲和层析应用的一个重要方面。
应用实例:2-胰凝乳蛋白酶的提纯
⒈亲和吸附剂(Σ-氨基-N-乙酰-D-色氨酸)的制备取一定体积的Sepharose4B加100mgCNBr。搅拌混合物,滴加2-8mol/l NaOH,使溶液pH维持在11.0。20℃左右,8-12分钟完成反应。在布氏漏斗中抽滤活化的琼脂糖,然后用20倍体积冷的0.1mol/l NaHCO3(pH9.0)溶液洗涤。将上述活化的Sepharose4B与等体积0.1mol/l NaHCO3(pH9.0并在冰箱中预冷)溶液混合,接着迅速加入α-胰蛋白酶抑制剂(Σ-氨基-N-乙酰-色氨酸甲酯)。抑制剂的**大用量为每毫升Sepharose 4B 65μmol/L。4℃缓慢搅拌约24小时,而后再用水和缓冲液反复地洗**没有游离的抑制剂为止。制得的亲和吸附剂在50mmol/l Tris-HCl缓冲液(pH8.0)中保存备用。
⒉分离 亲和吸附剂装柱后用50mmol/L Tris-HCl(pH8.0)缓冲液平衡(室温)。样品溶于同样缓冲液中并上柱,再应用同样缓冲液淋洗柱子。流速为30-60ml/小时,直**280nm无光吸收时停止洗涤,然后改用0.2mol/L醋酸缓冲液(pH3.0)洗脱。 (五)聚焦层析法
聚焦层析是一种操作简单、廉价的层析技术。它的原理是根据各种蛋白质的等电点不同进行分离的过程,因此本方法具有高分辨、高度浓缩和高度专一等特点。聚焦层析所用的凝胶shou先用高pH溶液平衡,然后用多元缓冲液进行洗脱,多元缓冲液pH呈梯度下降。
聚焦层析所用凝胶主要有两种:MONOP和多元缓冲液交换剂(PBE)。其中MONOP是带孔小珠,孔中被带正电荷的胺基填充,适用于高效聚焦层析。多元缓冲液交换剂是一种交换凝胶,适用作普通聚焦层析的介质。各种凝胶性质见表16-8。
表16-8 聚焦层析技术数据

NONOP可制成两种高效液相柱:MONOp HR5/5(1ml),和MONOp HR5/20(5ml)。使用时根据样品复杂性选择相应的柱。HR5/5分辨率为pI>0.2,HR5/20pI>0.02。
多元缓冲液交换剂PBE,属珠状交换剂凝胶,有PBe 118(pH11-8)和PBE(pH9-4)。在聚焦层析时,通过使用不同的洗脱液,可使交换容量发生改变,并且使pH达到更广的范围。
聚焦层析原理可以从PH梯度溶液的形成、蛋白质的行为和聚焦效应三方面来阐述。 1、PH梯度溶液的形成
在离子交换层析中,PH梯度溶液的形成是靠
梯度混合仪实现的。例如,当使用阴离子 剂进行层析时,制备PH由高到低呈线性变化的梯度溶液的方法是,在梯度仪的混合室(这层析柱者)中装高PH溶液,而在另一室装低PH极限溶液,然后打开层析柱的下端出口,让洗脱液连续不断地流过柱体。这时从柱的上部到下部溶液的PH值是由高到低变化的。而在聚焦层析中,当洗脱液流进多缓冲交换剂时,由于交换剂带具有缓冲能力的电荷基团,故PH梯度溶液可以自动形成。例如,当柱中装阴离子交换剂PBE94(作固定相)时,先用起始缓冲液(配方见表了一2)平衡到PHg,再用含PH6的多缓冲剂物质(作流动相)的淋洗液通过柱体,这时多缓冲剂中酸性**强的组分与碱性阴离子交换对结合发生中和作用。随着淋洗液的不断加人,住内每点的PH值从高到低逐渐下降。照此处理J段时间,从层析柱顶部到底部就形成了PH6~9的梯度。聚焦层析柱中的PH梯度溶液是在淋洗过程中自动形成的,但是随着淋洗的进行,PH梯度会逐渐向下迁移,从底部流出液的PH却由9逐渐降**6,并**后恒定于此值,这时层析柱的PH梯度也就消失了。 2.蛋白质的行为
蛋白质所带电荷取决于它的等电点(PI)和层析柱中的PH值。当柱中的PH低于蛋白质的PI时,蛋白质带正电荷,且不与阴离于交换剂结合。而随着洗脱剂向前移动,固定相中的PH值是随着淋洗时间延长而变化的。当蛋白质移动**环境PH高于其PI时,蛋白质由带正电行变为带负电荷,并与阴离子交换剂结合。由于洗脱剂的通过,蛋白质周围的环境PH 再次低于PI时,它又带正电荷,并从交换剂解吸下来。随着洗脱液向柱底的迁移,上述过程将反复进行,于是各种蛋白质就在各自的等电点被洗下来,从而达到了分离的目的。
不同蛋白质具有不同的等电点,它们在被离子交换剂结合以前,移动之距离是不同的,洗脱出来的先后次序是按等电点排列的 离子交换层析法 (Ion exchange chromatography)
这个部份,我们分成四个项目说明离子交换层析法。
1. 1. 基本原理:包括离子交换法的原理和步骤。
2. 2. 树脂材质:介绍常用的阴阳离子交换树脂成份。 #p#分页标题#e#
3. 3. 离子交换剂的选择:如何选用适当的阴(阳)离子交换剂和缓冲液。 4. 4. 离子交换树脂的前处理:使用树脂前的注意事项和处理方法。 一、基本原理
离子交换层析法 (ion exchange chromatography,简称IEC)是从复杂的混合物中,分离性质相似大分子的方法之一,依据的原理是物质的酸碱性、极性,也就是所带阴阳离子的不同。电荷不同的物质,对管柱上的离子交换剂有不同的亲和力,改变冲洗液的离子强度和pH值,物质就能依次从层析柱中分离出来。
离子交换层析法大致分为5个步骤: 1. 1. 离子扩散到树脂表面。
2. 2. 离子通过树脂扩散到交换位置。 3. 3. 在交换位置进行离子交换;被交换的分子所带电荷愈多,它与树脂的结合愈紧密,也就愈不容易被其它离子取代。
4. 4. 被交换的离子扩散到树脂表面。
5. 5. 冲洗液通过,被交换的离子扩散到外部溶液中。
离子交换树脂的交换反应是可逆的,遵循化学平衡的规律,定量的混合物通过管柱时,离子不断被交换,浓度逐渐降低,几乎全部都能被吸附在树脂上;在冲洗的过程中,由于连续添加新的交换溶液,所以会朝正反应方向移动,因而可以把树脂上的离子冲洗下来。
如果被纯化的物质是氨基酸类的分子,则分子上的净电荷取决于氨基酸的等电点和溶液的pH值,所以当溶液的pH 值较低,氨基酸分子带正电荷,它将结合到强酸性的阳离子交换树脂上;随着通过的缓冲液pH逐渐增加,氨基酸将逐渐失去正电荷,结合力减弱,**后被洗下来。由于不同的氨基酸等电点不同,这些氨基酸将依次被洗出,**先被洗出的是酸性氨基酸,如apartic acid和glutamic acid(在约pH3~4时),随后是中性氨基酸,如glycine和alanine。碱性氨基酸如arginine和lysine在pH值很高的缓冲液中仍带有正电荷,因此这些在约pH值高达10~11时才出现。

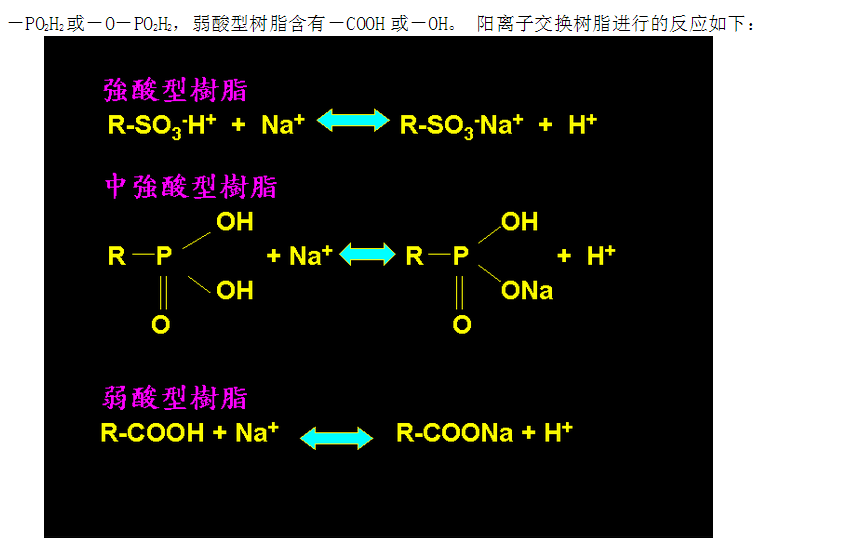

-PO2H2或-O-PO2H2,弱酸型树脂含有-COOH或-OH。 阳离子交换树脂进行的反应如下:
2. 2. 阴离子交换树脂
分为强碱型、中强碱型和弱碱型三类,含有铵盐,四级铵盐 [ -N+(CH3)3] 为强碱型树脂,三级以下铵盐 [-N(CH3)2]、[ -NHCH3]、[ -NH2] 都属弱碱型树脂;同时具有强碱和弱碱型基团的,为中强碱型的树脂。阴离子交换树脂进行的反应如下:
除了树脂以外,纤维素(cellulose)、葡聚糖凝胶(Sephadex gel)和琼脂糖凝胶(Sepharose)也是常用的离子交换材质,特性是具有亲水性和较大的表面积,对生物活性物质而言,是一个较为温和的环境,同时也是大分子所适用的分离纯化材质 。常用的种类如下:
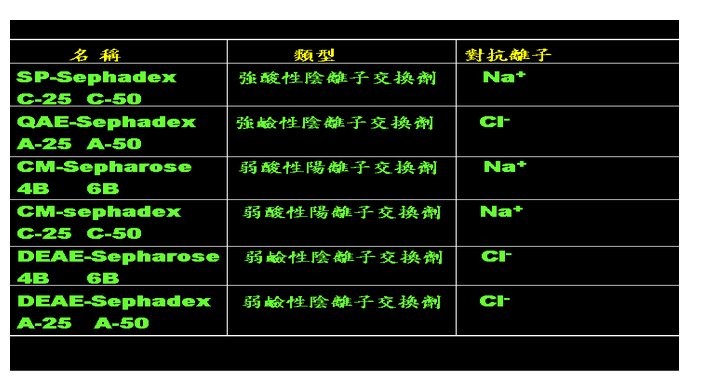
实验证明,纤维材质对蛋白质和核酸的分离纯化效果相当好,因为离子交换纤维的种类多,能依据不同分离目的使用,且功能团基主要在表面,对生物大分子的交换十分有利。
三、离子交换剂的选择
离子交换剂的选择,shou重保持欲分离物质的生物活性,以及在不同pH值环境中,此物质所带的电荷和电性强弱。
1. 1. 阴阳离子交换剂的选择
若被分离物质带正电荷,例如polymyxin、 cytochrome C这些碱性蛋白质,它们在酸性溶液中较稳定,亲和力强,故采用阳离子交换剂;其它像heparin、nucleic acid这类酸性物质,在碱性溶液中较稳定,则使用阴离子交换剂;如果欲分离的物质是两性离子,一般考虑在它稳定的pH范围带有何种电荷,作为交换剂的选择。以胰岛素(insulin)为例,它的等电点为pH 5.3,因此在pH<5.3(酸性)溶液中,采用阳离子交换剂,在pH>5.3的碱性溶液中,使用阴离子交换剂。
简言之,已知等电点的物质,在高于等电点的pH条件下,因带有负电荷,应采用阴离子交换,在低于等电点的pH下,则采用阳离子交换。未知等电点的物质,在一定pH条件下进行电泳,向阳极移动较快的物质,在同样条件下可被阴离子交换剂吸附,向阴极移动较快的物质可被阳离子交换剂吸附。
2. 2. 缓冲液的选择
缓冲液酸碱度的选择,决定于被分离物质的等电点、稳定性、溶解度和交换剂离子的pK值。使用阴离子交换纤维时要选用低于pK值的缓冲液,若欲分离的物质属于酸性,则缓冲液的pH值要高于该物的等电点;用阳离子交换纤维时要选用高于 pK值的缓冲液,目的物属于碱性物质的话,缓冲液要低于该物等电点的pH值。 #p#分页标题#e#
缓冲液离子以不干扰分离物活性测定、不影响待测物溶解度、不发生沉淀为原则,如使用UV吸收法测样品,那么pyridine或barbital这类会吸收UV的物质就不适用。
四、离子交换树脂的前处理
离子交换树脂使用前,先以蒸馏水除去其内之杂质 ,并以NaOH和HCl处理树脂,使其上的官能基完全露出。阴离子交换树脂先以15倍于树脂量的0.5 N HCl 浸泡30~120分钟,再以水清洗**pH 7.0,之后用0.5 N NaOH浸泡30~120分钟,同样以水清洗**pH 7.0,**后用欲使用的缓冲液浸泡。阳离子交换树脂用15倍于树脂量的0.5 N NaOH浸泡30~120分钟,以水清洗**pH 7.0,之后用0.5 N HCl 浸泡30~120分钟,再以水清洗**pH 7.0,**后用欲使用的缓冲液浸泡。