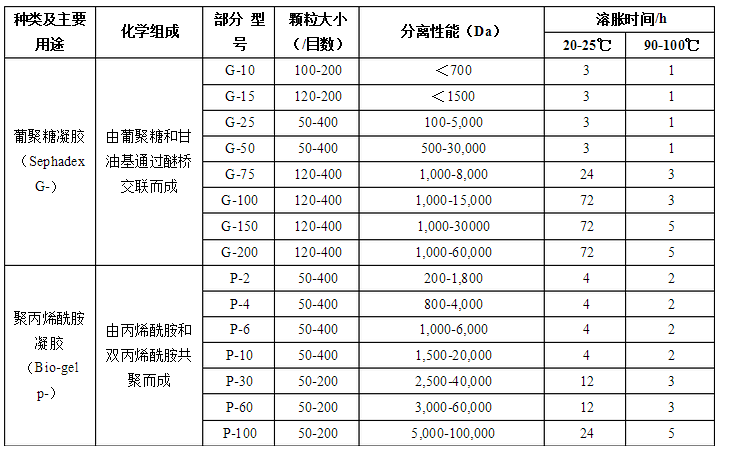
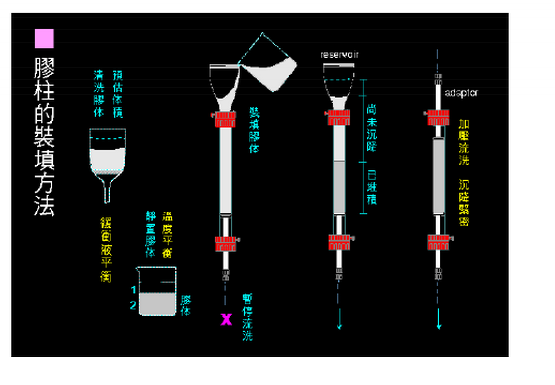
→流动平衡(装填后放置一段时间,再开始流动平衡,流速应低于层析时所需的流速。在平衡过程中逐渐增加到层析的流速,千万不能超过**终流速。平衡凝胶床过夜)→落柱头(小体积,流速压力判断,大体积,可接压力表)
实验室用:肉眼观察均匀、无纹路、无气泡,有色物质如蓝色葡聚糖-2000(2mg/mL)、血红蛋白等上柱,观察有色区带在柱中的洗脱行为以检测凝胶柱的均匀程度。如果色带狭窄、平整、均匀下降,则表明柱中的凝胶填装情况较好,可以使用;如果色带弥散、歪曲,则需重新装柱。 生产中:用测量层析柱柱效及对称性的来检定层析柱是否可投入生产中使用。 注:新凝胶柱可以能过提高缓冲体系中盐离子的浓度来降低非特异性吸附的程度。 层析柱的处理:
加样前去除样品中的不溶物,样品浓度与分配系数无关,查粘度影响运动。 加样要求快速均匀,加样体积,分级分离时为柱体积的1%~5%,分组分离时为柱体积的10%~30%。 洗脱:
半收缩保存:用完以水冲洗,60%~70%酒精冲洗,待凝胶体积缩小,浸泡于70%乙醇中保存; 干燥保存(长期不用):用完后水冲洗,滤干,低浓度乙醇水洗,逐渐加大乙醇用量(50%、70%、90%、95%,防止结块),**后用95%乙醇洗,全部去水,再用乙烯或乙醚除乙醇,抽滤干,60℃~80℃干燥后保存。
3. 应用:
脱盐:适用的凝胶为SephadexG-10、15、25及Bio-Gel-p-2、4、6或Ultragel AcA 202等排阻极限较小的凝胶类型 ,柱长与直径之比为5-15,样品体积可达柱床体积的25%-30%;(为了防止蛋白质脱盐
后溶解度降低会形成沉淀吸附于柱上,一般用醋酸铵等挥发性盐类缓冲液使层析柱平衡,然后加入样品,再用同样缓冲液洗脱,收集的洗脱液用冷冻干燥法除去挥发性盐类。)
溶液浓缩:利用凝胶颗粒的吸水性,将干燥的Sephadex(粗颗粒)加入溶液中,Sephadex可以吸收大量的水,溶液中的小分子物质也会渗透进入凝胶孔穴内部,而大分子物质则被排阻在外,通过离心或过滤去除凝胶颗粒,即可得到浓缩的样品溶液(这种浓缩方法基本不改变溶液的离子强度和pH值);
分子量的计算与蛋白复性……
离子交换层析(Ion Exchange Chromatography, IEC)
1. 离子交换剂组成:高分子聚合物基质、电荷基团、平衡离子。
亲水性:主要分离无机离子、有机酸、核苷等小分子物质;其次用于从蛋白质溶液中除表面活性剂、两性电解质等;也可用于分离某些不易变性的蛋白质。
阳离子交换剂:电荷基因带负电,平衡离子带正电,可与带正电离子基团发生交换。一般结合磺酸基团(-SO3H),如磺酸甲基(简写为SM)、磺酸乙基(SE)等为强酸型离子交换剂;结合磷酸基团(-PO3H2)和亚磷酸基团(-PO2H)为中等酸型离子交换剂;结合酚羟基(-OH )或羧基(-COOH),如羧甲基(CM)为弱酸型离子交换剂。
强酸性阳离子交换树脂:R-SO3H(磺酸基)和R-CH2SO3H(次甲基磺酸基)R代表基质(树脂) 中酸性阳离子交换树脂:R-PO3H2,R-POH2
弱酸性阳离子交换树脂:R-COOH,R-OCH2COOH,R-C6H5OH等弱酸性基团; 强酸性:R-SO3 -H+
+ Na+
—— R-SO3- Na+
+ H+
弱酸性:R-COOH+Na+
—— R-COONa +H+
阴离子交换剂:电荷基因带正电,平衡离子带负电,可与带负电离子基团发生交换。一般结合季胺基团(-N(CH3)3),如季胺乙基(QAE)为强碱型离子交换剂;结合叔胺(-N(CH3)2)、仲胺(-NHCH3)、伯胺(-NH2)等为中等或弱碱型离子交换剂;如结合二乙基氨基乙基(DEAE)为弱碱型离子交换剂。
强碱性阴离子交换树脂:活性基团为季胺基团,如三甲胺基或二甲基-ß-羟基乙基胺基 中碱性阴离子交换树脂:活性基团为叔胺基团 弱碱性阴离子交换树脂:活性基团为伯胺或仲胺 R-N+(CH3)3OH- +Cl-
—— R-N+(CH3)3Cl-+OH
-
疏水性:
纤维素离子交换剂:分阳离子与阴离子交换纤维,骨架松散、亲水性强、表面积大、交换容量大、吸附力弱、交换和洗脱条件温和、分辨率高。
常用的有:甲基磺酸纤维素、羧甲基纤维素(CMC)、二乙基氨基乙基纤维素(DEAE)
交联葡聚糖离子交换剂:分阳离子与阴离子交换树脂,除了具有离子交换功能以外,兼有分子筛的功能,提高了分离的效率。
常用:CM-sephadex C-25、DEAE-sephadex A-50等。
琼脂糖离子离交换剂:将电荷基团(DEAE-或CM-等基团)附着在Sepharose CL-6B 上形成
常用:DEAE-Sepharose(阴离子)、CM-Sepharose(阳离子)
2. 洗脱顺序:平衡离子反电荷物质/中性物质、小结合力物质、大结合力物质。
3. 结合强度的影响因素:离子交换剂性质、离子自身性质、离子强度、pH、温度、溶剂组成等。
eg.蛋白等生物大分子通常呈两性,与pH关系较大,在一定的pH条件下,等电点pI高于pH的蛋白带正电,能与阳离子交换剂结合,一般pI越高的蛋白与离子交换剂结合力越强。
4. 交换容量的测定:阳离子交换剂shou先用HCl处理,使其平衡离子为H+,再用水洗**中性,对于强酸型离子交换剂,用NaCl充分置换出H+,再用标准浓度的NaOH滴定生成的HCl,就可以计算出离子交换剂的交换容量;对于弱酸型离子交换剂,用一定量的碱将H+充分置换出来,再用酸滴定,计算出离子交换剂消耗的碱量,就可以算出交换容量。阴离子交换剂方法同此。 5. 离子交换剂的选择:
阴阳选:被分离物质带正电,选阳离子交换剂;被分离物质带负电,选阴离子交换剂。 #p#分页标题#e#
缓冲液pH比有效成分的pI高一个单位(选用阴离子交换剂) 缓冲液pH比有效成分的pI低一个单位(选用阳离子交换剂)
基团选:小分子物质/极端pH条件分离,选强酸或强碱型离子交换剂;蛋白质等大分子易变性,选弱酸或弱碱型离子交换剂。
基质选:聚苯乙烯离子交换剂(聚苯乙烯树脂),机械强度大、流速快、强疏水性、易使蛋白变性,常用于分离小分子物质如无机离子、氨基酸、核甘酸;纤维素(Cellulose)、球状纤维素(Sephacel)、葡聚糖(Sephadex)、琼脂糖(Sepharose),与水有较强亲和力,适合蛋白质等大分子物质。[纤维素,价格低,分辨率、稳定性低,适于初步分离与大量制备;葡聚糖,分辨率、价格适中,受外界影响大(体积受离子强度与pH影响大);琼脂糖,分辨率、稳定性高,价格贵。]
eg. DEAE-纤维素(二乙基氨基纤维素)和CM-纤维素(羧甲基纤维素)交换容量大、亲水性、洗脱温和、回收率高,在生物大分子物质(蛋白质,酶,核酸等)的分离中**常用。
颗粒选:颗粒小,分辨率高,平衡时间长,流速慢,适合于对分辨率要求不高,大规模制备性分离;颗粒大,分辨率低,平衡时间短,流速快,适合于对分辨率要求较高,小规模分析性分离。 6. 离子交换剂的处理保存:
处理程序:
膨化,干粉在水中溶胀,用水悬浮,除杂质与细小颗粒;
新出厂干树脂用水浸泡2小时后减抽压去气泡,倾去水,再用大量无离子水洗**澄清,去水后加4倍量2M HCl搅抖4小时,除去酸液,水洗到中性,再加4倍量2M NaOH搅拌4小时,除碱液,水洗到中性备用。
酸碱浸泡,原则浓度不宜过高、时间不宜过长、温度不宜过高,每种溶剂浸泡间用水洗**中性,阳离子交换剂后用碱处理(NaOH+NaCl,Na型),阴离子交换剂后用酸处理(HCl,Cl型),一般浓度低于0.5mol/L,浸泡时间30min,**后也用水洗**中性(为进一步除杂,带平衡离子,通常阳离子交换剂带Na离子,阴离子交换剂带Cl离子),除尽气泡; 再生,酸碱交替浸泡,选择合适的平衡离子,同前。 保存,洗净,加防腐剂(0.02%叠氮钠),4℃下保存,也可保存在10mM NaOH/20%乙醇溶液或是两者的混合液中。
7. 层析基本操作流程:
装柱,粗而短,不宜过长过短,垂直,均匀,平整,无气泡; 前处理,(再生的一个过程)高浓度碱盐(1M NaCl,1~2个柱床体积)将层析介质原挂有的离子置换下,使平衡过程中能被置换的离子均匀挂上;(少用) 平衡,平衡体系一般采用缓冲溶液+保护剂的模式,常用的平衡体系有TE缓冲体系、Ac缓冲体系、PB缓冲体系和碳酸缓冲体系等,常用的保护剂有EDTA及吐温系列等(为了达到较好的平衡效果,在平衡前经常加一预平衡过程,采用的是较高浓度的缓冲体系冲一柱床体积,目的是为了较快的将层析柱上的酸碱离子置换下来。);
上样,检测样品液离子强度与pH值,应与缓冲体系pH值相当(±0.5); 冲柱,平衡缓冲液,1~2个柱体积;
洗脱,梯度(改变离子强度或pH,改变离子强度通常是在洗脱过程中逐步增大离子强度,从而使与离子交换剂结合的各个组分被洗脱下来;而改变pH的洗脱,对于阳离子交换剂一般是pH从低到高洗脱,阴离子交换剂一般是pH从高到低),流速恒定(提高分辨可通过降低流速); 样品收集,一般收集3/5/6个样品; 后处理,同前处理;
封柱,若短时间不用,则用封柱液(封柱液有10mM的NaOH、20%乙醇和0.1%的叠氮钠)封柱。 8. 实例
水处理:一般是将水依次通过H+型强阳离子交换剂,去除各种阳离子及与阳离子交换剂吸附的杂质;再通过OH- 型强阴离子交换剂,去除各种阴离子及与阴离子交换剂吸附的杂质,即可得到纯水。再通过弱型阳离子和阴离子交换剂进一步纯化,就可以得到纯度较高的纯水。
小分子氨基酸:使用强酸性阳离子聚苯乙烯树脂,将氨基酸混合液在pH 2~3上柱。这时氨基酸都结合在树脂上,再逐步提高洗脱液的的离子强度和pH,这样各种氨基酸将以不同的速度被洗脱下来,可以进行分离鉴定。
亲和层析
1. 本质:静电作用、氢键、疏水作用、配位键、弱共价键…… 2. 专一亲和配对物:
抗原与抗体、DNA与互补DNA或RNA、酶与它的底物或竞争性抑制剂、激素(或药物)与它们的受体、维生素和它的特异结合蛋白、糖蛋白与它相应的植物凝集素等。
eg.蛋白质-组氨酸
3. 影响因素:
离子强度、pH值、氢键抑制剂(脲、盐酸胍)、温度(提高温度,静电作用、氢键、配位键减弱;但是,疏水性相互作用增强)、螯合剂(影响配位键)、离液离子(SCN-、I-、CIO4-,疏水作用减弱)。 4. 过程:载体活化、配基连接、吸附、吸脱。 5. 介质:基质-手臂-配体。
基质:纤维素、聚丙烯酰胺凝胶、交联葡聚糖、琼脂糖、交联琼脂糖、多孔玻璃珠等。
eg. Sepharose 4B
配体:特异性配体。eg. 生物素和亲和素、抗原和抗体、酶和它的抑制剂、激素-受体等。 通用性配体。eg. 凝集素。 #p#分页标题#e#
手臂:适当长度的氨基化合物NH2(CH2)nR(R=氨基/羧基,n=2~12) 6. 制备过程:
基质活化:
溴化腈活化法,方法,琼脂糖与等体积水混合,加入溴化腈,用NaOH调节pH11,20℃维持3~12 min,迅速加入大量冰屑,布氏漏斗抽滤,缓冲液抽滤洗涤,反应过程如下:
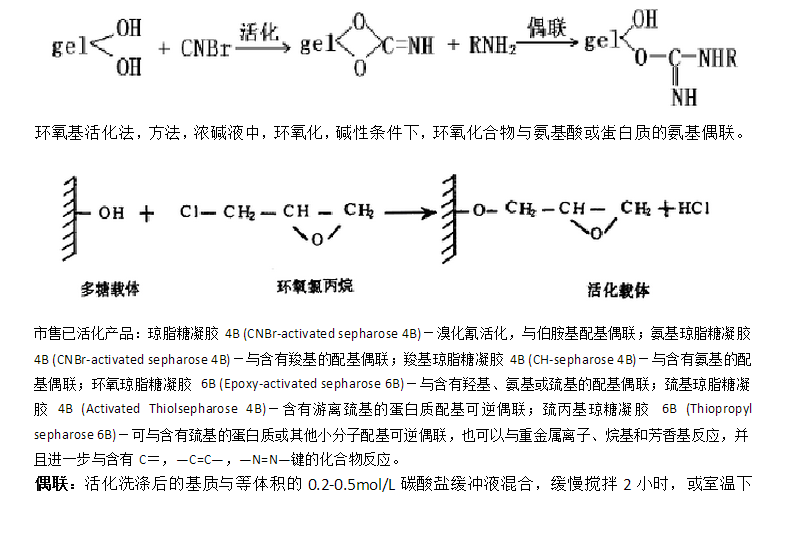
过夜,以便配体和基质充分偶联而形成固体载体,对于偶联极牢固会丧失活性的大分子物质配体,则应在低pH值缓冲液中反应或活化基质预先在pH8.3的碱性溶液中进行适当的水解作用,这样可提高配体的活性,配体和基质偶联完毕后,必须要反复洗涤,以去除未偶联的配体,另外要用适当的方法封闭基质中未偶联上配体的活性基团,也就是使基质失活,以免影响后面的亲和层析分离。
eg.对于能结合氨基的活性基团,常用的方法是用2-乙醇胺、氨基乙烷等小分子处理。
配体结合量测定:测定方法有直接测定法(2,4,6-三硝基苯磺酸钠的颜色试验和根据配体的特征来进行测定)和间接测定法(推算法和根据亲和吸附剂对被吸附物质的操作容量可计算配体的结合量)。 7. 分离过程:在低温下进行(4℃)
平衡:2~3倍体积缓冲液。
吸附:选择吸附柱时,吸附能力强用短柱,吸附能力弱时用长柱;上样溶剂用起始缓冲液,可用起始缓冲液溶解固体,已溶溶液用透析将溶剂换成起始缓冲液;上样量小于吸附容量1/3,吸附力弱则为1/10。
冲洗:10倍柱体积缓冲液洗掉不结合的杂质,流速为获得**尖锐洗脱峰和**小洗脱体积的流速。 洗脱:洗脱时可先让洗脱剂在柱子中停留半小时的方法,尽量避免分离物质失活。(洗脱后应注意中和酸碱,透析去除离子,以免待分离物质丧失活性。) 保存:使用过的亲和层析柱,一般用大量的洗脱液或较高浓度的盐溶液洗涤,**后用平衡缓冲液(平衡缓冲液应与样品缓冲液一致)使亲和层析柱平衡,即可重复使用,暂时不用时,加入0.01%的叠氮化钠,4℃下保存,也可以加入0.5%的醋酸洗必泰或0.05%的苯甲酸。应注意不要使亲和吸附剂冰冻。(注意处理时不能改变配体的活性。) 8. 应用:
纯化大分子物质:抗原、抗体,糖蛋白,核酸等稀溶液的浓缩;不稳定蛋白质的贮藏;从纯化的分子中除去残余的污染物;用免疫吸附剂吸附纯化对此尚无互补配体的生物大分子;分离核酸是亲和层析应用的一个重要方面。
研究酶的结构与功能:使用专一的化学试剂改变酶的功能团,会引起酶活力的不完全丧失,难以确定酶活力的改变是化学试剂的作用还是残留的天然酶活力,利用亲和层析能有效地将失活的酶和天然的酶有效的分离
亲和色谱可用于下列生物体系
酶:底物、抑制剂、辅酶;抗体:抗原、病毒、细胞;外源凝集素:多糖、糖蛋白、细胞表面受体;细胞核酸:互补碱基序列、组蛋白、核酸聚合酶 、结合蛋白;激素及维生素:受体、载体蛋白;细胞:细胞表面特异蛋白、外源凝集素
其他层析
1. 吸附层析 2. 聚焦层析 3. 疏水层析