离子交换层析(色谱) 一、原理
离子交换层析(Ion exchange chromatography, IEC)是利用离子交换剂为固定相,根据荷电溶质与离子交换剂之间静电相互作用力的差别进行溶质分离的层析法。
荷电溶质在离子交换剂上的分配系数可用下式表示:
I — 流动相的离子强度,A和B为常数, 为离子强度无限大时溶质的分配系数,是静电相互作用以外的非特异性吸附引起的溶质在离子交换剂上的分配。 离子交换基: 阴离子:DEAE(二乙胺乙基); QAE(季胺乙基) 阳离子:CM(羧甲基);SP(磺丙基)
对于蛋白质等两性电解质,在物理意义上,B为溶质的静电荷数与离子价数之比。在pH偏离等电点的溶液中,蛋白质溶质的静电数常为两位数以上,故B值较大,即蛋白质的分配系数对离子强度非常敏感。在同一离子强度下,不同蛋白质的分配系数相差非常大(几个数量级)。 洗脱方式:
恒定洗脱法:洗脱液(流动相)的离子强度不变;
缺点:对于在吸附柱上分配系数相差较大的蛋白质很难实现很好的分离。 线性梯度洗脱法或阶段梯度洗脱法:
除GFC以外的层析操作均采用此种方法。
在洗脱过程中,流动相的离子强度线性增大或阶段梯度增大,因此溶质的分配系数连续降低,移动速度逐渐增大,使恒定洗脱条件下难于脱附的溶质得到洗脱。 线性梯度洗脱和阶段梯度洗脱法的优缺点如下: (1)线性梯度洗脱法:
优点:流动相离子强度(盐浓度)连续增大,不出现干扰峰,操作范围广; 缺点:需要特殊的调配浓度梯度的设备。 (2)阶段梯度洗脱法:
优点:利用切换不同盐浓度的流动相溶液进行洗 脱,不需要特殊梯度设备,操作简单; 缺点:因为流动相浓度不连续变化,容易出现干扰峰。
此外,容易出现多组分洗脱峰重叠的现象,因此洗脱操作参数(如盐浓度体积)的设计较困难。 离子交换(IEC)的应用及特点
GFC — 主要用于产物的初步纯化和中后期脱盐
IEC — 是蛋白质、肽和核酸等生物产物的主要纯化手段 IEC分离的特点:
(1)料液处理量大,具有浓缩作用,可在较高流速下操作;
(2)应用范围广泛,优化操作条件可大幅度提高分离的选择性,所需柱长较短; (3)产品回收率高;
(4)商品化的离子交换剂种类多,选择余地大,价格也远低于亲合吸附剂。
疏水作用层析(色谱) 一、原理
疏水作用层析(Hydrophobic interaction chromatography, HIC)是利用表面偶联弱疏水性基团的疏水吸附剂为固定相,根据蛋白质与疏水性吸附剂之间的弱疏水性相互作用的差别进行蛋白质类生物大分子分离纯化的洗脱层析法。
二、疏水性吸附剂:将下表所列的各种凝胶过滤介质偶联上疏水性配基后均可用作疏水性吸附剂。
常用的疏水性配基:苯基、短链烷基(C3~C8)、烷氨基、聚乙二醇和聚醚等。 吸附特点:
疏水性吸附作用的大小与配基的疏水性(疏水链长度)和配基密度成正比,故配基修饰密度应根据配基的疏水性而异,疏水性高的配基较疏水性低的配基修饰密度低。一般配基修饰密度在10 ~ 40mol/ml,配基修饰密度过小则疏水性吸附不足,密度过大则洗脱困难。
三、HIC操作
上样及洗脱的一般规律:
在高盐浓度条件下,蛋白质与固定相疏水缔合;浓度降低时,疏水作用减弱,逐步被洗脱下来。一般用pH 6-8的盐水溶液[如(NH4)2SO4]。盐的浓度影响蛋白质的疏水性,从而影响蛋白质的保留值。
盐:Na2SO4,KH2PO4,NaHPO4,(NH4)2SO4,NH4OAc,KOAc,NaOAc,NaCl --〉 盐析作用增强 《-- 洗脱能力增强
1、影响疏水性吸附的因素 蛋白质的疏水性与其荷电性质相比复杂得多,不易定量掌握。除疏水性吸附剂的性质(疏水性配基的结构和修饰密度)外,流动相的组成以及操作温度对蛋白质疏水性吸附的强弱均产生重要影响。
(1)离子强度及种类 蛋白质的疏水性吸附作用随离子强度提高而增大。离子的种类亦影响蛋白质的疏水性吸附。疏水性吸附与盐析沉淀一样,在高价阴离子的存在下作用力较高。因此HIC分离过程中主要利用硫酸铵、硫酸钠和氯化钠等盐溶液为流动相,在略低于盐析点的盐浓度下进料,然后逐渐降低流动相离子强度进行洗脱分离。 (2)破坏水化作用的物质
, ,和 等离子半径较大、电荷密度低的阴离子可减弱水分子之间相互作用。这类阴离子与上述盐析作用强的高价阴离子(如 , 等)的作用正好相反,前者称为离液离子(chaotropic ion),后者称为反离液离子(antichaotropic ion)。在离液离子存在下疏水性吸附减弱,蛋白质易于洗脱。 #p#分页标题#e#
除离液离子外,乙二醇和丙三醇等含羟基的物质也具有影响水化的作用,降低蛋白质的疏水性吸附作用,经常用做洗脱促进剂,洗脱疏水吸附强烈、仅靠降低盐浓度难于洗脱的高疏水性蛋白质。
(3)表面活性剂 表面活性剂可与吸附剂及蛋白质的疏水部位结合,从而减弱蛋白质的疏水性吸附。根据这一原理,难溶于水的膜蛋白质可添加一定量的表面活性剂使其溶解,利用HIC法进行洗脱分离。但此时选用表面活性剂的种类和浓度应当适宜:浓度过小则膜蛋白不溶解,过大则抑制蛋白质的吸附。 (4)温度
一般吸附为放热过程,温度越低吸附结合常数越大。但疏水性吸附与一般吸附相反,吸附结合作用随温度升高而增大。蛋白质疏水部位的失水有利于疏水性吸附,而失水是吸热过程,即疏水性吸附为吸热过程, 0 因为: 所以吸附平衡常数K随温度的升高而增大。
2,蛋白质的分离
蛋白质与HIC填料之间的作用很复杂,有时不能完全用疏水性相互作用来解释,有时配基苯环还会与蛋白质分子上的芳香族氨基酸产生-键。因此,在利用HIC分离蛋白质混合物时,需事先利用各种小型预装柱进行吸附与洗脱实验,确定**佳吸附剂和洗脱剂。 3,HIC的特点
HIC主要用于蛋白质类生物大分子分离纯化。虽然HIC不如IEC应用昔遍,但可作为IEC的补充工具。如果使用方法适当,HIC具有与IEC相近的分离效率.归纳而言,H1C具有如下特点:
(1) 由于在高浓度盐溶液中疏水性吸附作用较大,因此,HIC可直接分离盐析后的蛋白质溶液; (2) 可通过调节疏水配基链长和密度调节吸附力,因此此可根据目标产物的性质选择适宜的吸附剂;
(3) 疏水性吸附剂种类多,选择余地大,价格与离子交换剂相当。 羟基磷灰石层析
羟基磷灰石(hydroxyapatite, HAP): 是一种磷酸钙晶体,基本分子结构为 一般认为,HAP的吸附主要基于钙高子和磷酸根离子的静电引力,即在HAP晶体表面存在两种不同的吸附晶面,各存在吸附点c点和P点,前者起阴离于交换作用,后者起阳离于交换作用.因此,在中性pH环境下酸性蛋白质(pI<7)主要吸附于c点,碱性蛋白质(PI>7)主要吸附于P点.利用磷酸盐缓冲液(K2HP04+KH2PO4)为流动相洗脱展开时,磷酸根离子在c点竞争性吸附,交换出酸性蛋白质,而K+在P点竞争性吸附,交换出碱性蛋白质。所以HAP层 析通常以磷酸盐缓冲液为流动相,采用提高盐浓度的线性梯度脱法。 应用:
由于HAP晶体表面结构特别,吸附机理特殊,因此可用于识别DNA及RNA的单链和双链,分离IEC和HIC难于分离的蛋白质物系。例如,人肿瘤坏死因子(human tumour necrosis factor,hTNF)的构成蛋白质分子差异很小, 利用IEC法、高效RPC法和电泳法只能得到一个洗脱峰或电泳带,而利用HAP层析可分离得到4个洗脱峰。
HAP吸附剂价格便宜,远低于高子交换剂,适用于大规模分离纯化过程,已成为单克降抗体的主要纯化手段。
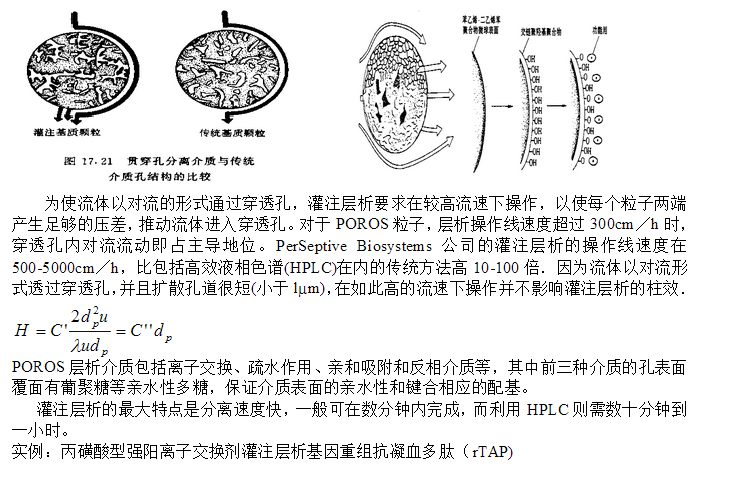
灌注层析(Perfusion chromatography)
灌注层析(Perfusion chromatography)是美*PerSeptive Biosystems公司于1989年开发的层析分离技术,Perfusion chromatography是该公司的注册商标.灌注层析的关键是其以POROS命名的固定相粒子的特殊结构;POROS的基质是聚苯乙烯—二乙烯苯,含有两种大小不同的孔道。大孔直径为0.6 ~ 0.8m,流体以对流形式通过,称为穿透孔(throughpore); 小孔直径与一般介质一样,直径500 ~ 1000 , 流体以扩散的形式通过,称为扩散孔(diffusive pore).如图所示,穿透孔之间以扩散孔相连,保证了
POROS介质的大比表面积和溶质吸附容量。同时,扩散孔道长度小于lm,溶质扩散所需时间极短,大大降低了利用传统介质进行层析分离的扩散传质阻力。
吸附剂体积: 1.25 L (25252) 上样液: 80ml,lmg rTAP/ml
冲洗:用相当于3倍柱体积的平衡液(0.1mol/L NaCl,0.05 mol/L富马酸钠,pH3.5)清洗 洗脱:用洗脱液(0.5mol/L NaCl,0.05mol/L富马酸钠,pH3.5)洗脱,第二个峰即为纯化的rTAP,收率为93.4%。
层析聚焦(Chromatofocusing)
层析聚焦是基于离子交换的原理,根据两性电解质分子间等电点的差别进行分离纯化的洗脱层析法.
层析聚焦利用离子交换剂为固定相,因此是一种离子交换层析法。但是,与一般IEC所不同的是,层析聚焦利用在较宽pH值范围内具有缓冲作用的多缓冲离子交换剂为固定相,同时利用在较宽pH值范围内具有缓冲作用的多缓冲剂为流动相。所以,当向层析柱内通入与柱内初始pH值不同的多缓冲剂时,柱内pH值缓慢改变,在轴向形成连续的pH梯度,使料液中的溶质依据各自的等电点或者吸附,或者脱附,逐次向下移动,彼此之间得到分离。 多缓冲剂:
多缓冲剂是两性电解质缓冲剂,由相对分子质量大小不一的各种多羧基多氨基化合物组成,存在各自的等电点。常用的多缓冲剂有Pharmacia公司生产的Polybuffer 96、Polybuffer 74和Pharmalyte等,缓冲pH范围分别为pH 9-6,pH 7-4和pH 10.5-8。在相应的缓冲pH范围内,各种多缓冲剂具有均衡的缓冲容量,在层析聚焦操作中提供平滑的pH梯度。 多缓冲离子交换剂: 可利用普通的凝胶过滤介质偶联特殊的离子交换基制备.如Pharmacia公司生产的PBEll8和94即为以Sepharose 6B为载体的阴离子交换剂,前者与Pharmalyte 匹配使用,后者与Polybuffer96和Polybuffer 74匹配使用。 #p#分页标题#e#
Pharmacia生产的另一种多缓冲离子交换剂为Mono P,其离于交换基为具有不同pKa值的弱碱性胺基.MonoP可与上述三种多缓冲剂匹配使用,粒径仅10m,用作高效层析聚焦柱的固定相。
层析聚焦的应用
层析聚焦需使用特殊的固定相和流动相,难于应用在大规模分离纯化过程,主要用于生化实验规模的样品制备或成分分析.但作为一种蛋白质分离纯化手段,层析聚焦的纯化效率极高,峰宽可小到0.02 – 0.05pH单位,可分力电点差仅0. 02的蛋白质。
